实验室新闻
课题组在《Journal of Controlled Release》发文细胞外囊泡递送蛋白药物用于乳腺癌治疗取得新进展
2022年7月22日,国际著名药学期刊Journal of Controlled Release在线发表了以我校生命科学学院关燕清教授和青年英才(博士后)张令坤为通讯作者的研究论文“Tumor cell-derived extracellular vesicles for breast cancer specific delivery of therapeutic P53”(肿瘤细胞来源细胞外囊泡用于乳腺癌靶向释放治疗性P53蛋白)。

研究表明,P53蛋白在细胞死亡调控机制中发挥着关键的作用,癌细胞P53突变和野生型P53蛋白的缺失与正常细胞发生癌变及乳腺癌转移密切相关。在肿瘤细胞中经常会聚积着大量突变的P53(mut-P53),突变型P53不具备抑制肿瘤的功能继而导致癌变的的发生。通过恢复癌细胞内野生型P53蛋白对凋亡的敏感性,促使癌细胞发生凋亡将是治疗癌症的有效手段。通过向乳腺癌细胞递送RP53可实现细胞正交性信号放大进而调控细胞命运尚未见报道。
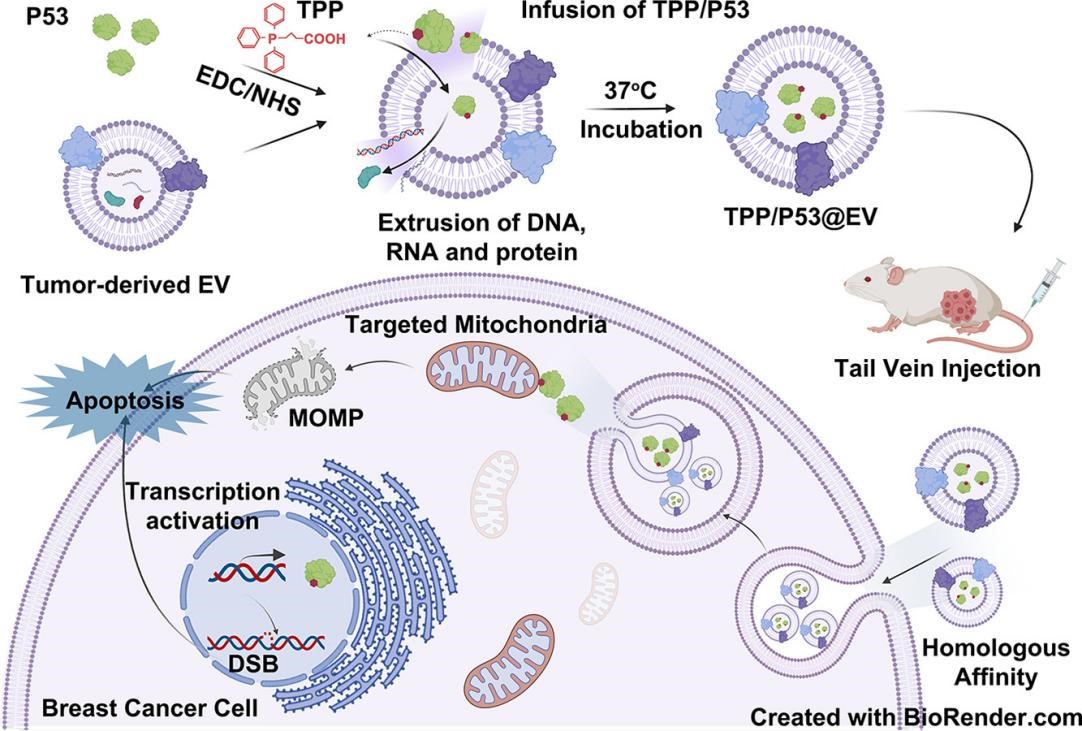
图1 TPP/P53@EV的合成及其线粒体靶向归巢抑制乳腺癌生长示意图
在该研究中,以不同乳腺癌细胞来源细胞外囊泡(EV)为载体,荷载通过三苯基膦(TPP)化学修饰的外源P53蛋白。该纳米复合物对其来源的乳腺癌细胞具有特异亲和性,不同乳腺癌细胞来源的EV具有亲本靶向归巢的能力,并能靶向跨膜渗透递送重组P53蛋白复合物作用于细胞的线粒体,并高效促使乳腺癌细胞凋亡。该研究首次利用乳腺癌细胞来源EV,发展治疗效率高且副作用低的人工生物蛋白纳米药物构建的理论体系。对基础研究转化为临床研究并最终建立规模化制备和质控标准用于乳腺癌的治疗具有重要的科学意义。
《Journal of Controlled Release》是国际控制释放学会(Controlled Release Society)的官方杂志,影响因子11.467,是国际药剂学领域排名第一的专业期刊。该研究成果是关燕清教授课题组近年来在纳米药物靶向递送用于乳腺癌治疗(Chem Engineer J 2019; 370: 749-759; Biomacromolecules 2018; 19(1): 31-41; J Mater Chem B 2022;10(3):418-429)研究基础上的进一步拓展和深化。华南师范大学生命科学学院为该论文的第一通讯单位,生命科学学院2021届本科生焦宇萱和唐云志为该论文的共同第一作者,关燕清教授和青年英才(博士后)张令坤博士为共同通讯作者。
该研究得到国家自然科学基金、广州市科技计划项目、中山大学眼科学国家重点实验室开放课题、广东大学生“攀登计划”专项基金和国家级大学生创新创业的资助等资助。
撰稿人:张令坤












